皆様お久しぶりです。trans(トランス)です。
諸事情により、2年以上更新をしていませんでした。ひょんなことから視聴数を確認したところ、予想以上に見ていただいていることが分かりました。
皆様の役に立っていることが、とても嬉しかったです。このような出来事から、もう一度、皆様のため、そして自分の能力向上のために、更新を再開することを決意しました。
今回は、脱水反応を用いて含水エタノールから無水エタノールを調製する実験について紹介していきます。
まず、無水エタノールの章では、無水エタノールの基本的な物理量や物性,”無水„という言葉の3通りの意味について紹介します。
次に、脱水反応の章では、脱水の方法,脱水時の化学反応式や理論質量,無水エタノールの回収量や回収率の算出方法,ろ過で用いるひだ付きろ紙について紹介します。
次に、加熱還流の章では、加熱還流の基本的な原理,今回の実験での利用方法,有機合成実験で多用される理由について紹介します。
次に、常圧蒸留の章では、常圧蒸留の原理や注意点について説明します。
最後に、屈折率の章では、屈折計の原理や使用方法について説明します。
実験の予習をやらなければいけないけど時間が無いという学生に向けて、予習の手間が省けるように、この記事を書いています。スマホを見ながら電車で予習することもできます。実験項目は某大学の実験テキストを参考にしています。
レベル的には大学の学部生レベルを想定していますが、高校生も化学の発展的なことが知りたければ読んでいただいて構いません。
それでは行きましょう!
1、無水エタノール

エタノールとは、アルコール消毒やお酒のアルコール成分として含まれる人間の生活には切っても切り離せない化学物質ですね。
まず、無水エタノールの物理定数について紹介します。といってもエタノールの物理定数と思ってもらえれば問題ありません。エタノールの物理定数以下の通りです。
化学式:C₂H₆O
モル質量:40.07 g/mol
外観の状態:無色透明の液体
密度:0.789 g/cm³
融点:-114.14 ℃
沸点:78.29 ℃
水に対する溶解度:基本的に任意に溶解可能
次に”無水„の3つの意味について説明します。
1つ目は物質としての水が含まれていないという意味です。今回の実験では、水を含んでいるエタノールを含水エタノールと表現し、水を含んでいないエタノールを無水エタノールと表現しています。
エタノール以外にも無水トルエン、無水アセトニトリルなどの脱水した溶媒に、この表現が多く用いられます。
2つ目は結晶水を持たないという意味です。
例としては、青色である硫酸銅(Ⅱ)五水和物(CuSO₄・5H₂O)を大気中で加熱すると、102℃で2個の水分子を失い硫酸銅(Ⅱ)三水和物(CuSO₄・3H₂O)、113℃でさらに2個の水分子を失い硫酸銅(Ⅱ)一水和物(CuSO₄・H₂O)、150℃で白色の硫酸銅(Ⅱ)無水物(CuSO₄)というように段階的に結晶水を失っていくものがあります。このように結晶中に水分子を一定の割合で含んでいる物質を水和物といい、これと結晶水を持たない同物質を区別するときに用います。
3つ目は分子内または分子間で水分子が脱離するという意味です。
分子内の脱水の例としてはマレイン酸が有名で、分子間の縮合の例としては酢酸が有名であります。それぞれ脱離した後の物質を無水マレイン酸、無水酢酸と言います。また、先ほど述べた2つの意味の無水とは異なり、ここでの無水物は元の化合物とは化学的な性質が大きく異なり全く別の物質になる事を注意しなければなりません。
無水酢酸については、前回の「アセトアニリドの合成 ~アセトアニリド,再結晶,TLC(薄層クロマトグラフィー),融点測定~」のアセトアニリドの章に少し記述があるので興味のある人は、そちらもご覧下さい。
2、脱水反応

まず、含水エタノールを脱水する方法について説明します。
脱水する方法は、①脱水剤を用いる方法と②共沸を行う方法の2つがあります。
①脱水剤
まず、脱水剤を使う方法について説明します。今回の実験では、こちらの方法を用いています。脱水作用のある固体物質をエタノールに加えることで水分を取り除くという方法です。ちなみに固体物質は脱水後、ろ過で取り除くことができます。今回の実験では脱水剤として、生石灰(酸化カルシウム)を用いています。
②共沸
次に共沸についてです。共沸とは、2つの液体成分の混合物質に第3の液体物質を加えることで、特定の1物質を蒸留によって取り除く方法のことです。今回のような場合、新たにベンゼンを加えて蒸留することで水を取り除くことができます。
2つの混合物の割合が水4.5%、エタノール95.5%になると液体も蒸留により発生する気体も同じ混合割合になります。つまり、含水エタノールは蒸留によっては95.5%以上純度を上げることができません。
しかし、ベンゼンを加えると3つの混合物となり、気体と液体の混合割合に変化が起きます。まず、3つの混合物(水、ベンゼン、エタノール)が64.9℃で取り除かれ、水が無くなると2つの混合物(ベンゼン、エタノール)が68.2℃で取り除かれます。そして最後に残ったのが沸点78.3℃の無水エタノールということになります。
つまり、共沸でのポイントはベンゼンを加えて水とエタノールの平衡を崩すことです。
次に、脱水剤を用いた含水エタノールの脱水を行ったときの化学反応式や理論質量について説明します。
水と生石灰の化学反応式は以下の通りです。
H₂O+CaO → Ca(OH)₂
上記の化学反応式を用いて、97(v/v)%エタノール100mLを脱水するのに必要な生石灰の理論質量を例として求めてみます。
まず、97(v/v)%エタノール100mLに含まれる水の量ですが、3(v/v)%が水であるので3mLになります。水の密度は1.0(g/mL)ですので3gということになります。
水3gは、水1molは18gなので下の式から0.167molとなります。
3(g)÷18(g/mol)≒0.167(mol)
水と生石灰は1対1で反応するため生石灰も0.167molが必要量となります。これをgに直すと生石灰1molは56.08gなので以下のような式になります。
0.167(mol)×56.08(g/mol)≒9.37(g)
よって、97(v/v)%エタノール100mLを脱水するのに必要な生石灰の理論質量は9.37gになります。
基本的には過剰量(理論質量の約2.5倍)の生石灰を加えるので実験では、
9.37(g)×2.5≒23.43(g)くらいの生石灰が必要になります。
次に、無水エタノールの回収量や回収率の算出方法について説明します。
まず、無水エタノールの回収量ですが基本的に体積(mL)ではなく、質量(g)で算出します。つまり、回収前の含水エタノールに関しても質量(g)で算出しておく必要があります。つまり、以下の式で回収率を算出することができます。
回収率(%) = {無水エタノールの回収量(g)÷回収前の含水エタノール(g)}×100(%)
この章の最後に、ろ過で用いるひだ付きろ紙について説明します。
まず、ひだ付きろ紙を用いる理由ですが、揮発する性質のある有機溶媒(エタノール)は素早くろ過する必要があり、液体とろ紙の接触面積を増やす必要があるからです。つまり、ろ紙の表面積を大きくするためです。
次に、ひだ付きろ紙の作り方についてです。
ひだ付きろ紙の作り方については、写真付きで分かりやすいサイトがあったので、そちらを参照していただければ良いと思います。リンクは以下の通りです。
3、加熱還流

おそらく、「何故ちくわ?」となったと思いますが、後ほど説明するので、今は気にしないでください(笑)。
まず、加熱還流の基本的な原理について説明します。とても分かりやすい図があったので、こちらを使用して説明していきます。
(下図引用:「還流」というイメージをめぐって)

まず、反応させたい物質(Reactants)を、熱源(Heat)からウォーターバスまたはオイルバスを介して加熱します。ちなみに、今回の実験の反応させたい物資は、含水エタノール中の水と生石灰になります。
では、なぜ加熱するのでしょうか?
理由は、とても簡単で反応を促進するためです。高温条件下のほうが、反応が早く進むことは感覚として分かると思います。なぜ、高温の方が早く反応が進むかを説明すると、それだけで1つの記事になってしまうので、またの機会に書きたいと思います。
ただ加熱しすぎると、液体は気体になってしまいます。気体になって、大気中に逃げてしまっては全く意味が無くなってしまいます。そこで活躍するのが、リービッヒコンデンサーになります。上図の縦に伸びているWater inからWater outが、これに該当します。
リービッヒコンデンサーとは、一本のガラス管の周りに水が通ることが出来るガラスでできたスペースが、ちくわの様に巻き付いている機会です。ようやく、ちくわが出てきましたね。伏線回収です。
加熱されて気体となった物質は、リービッヒコンデンサーに流れる水によって冷却され、液体に戻ります。その液体は、上図のReactantsに、戻り再び反応が促進されます。
つまり、加熱還流とは、加熱して反応を促進させ、加熱により気体となった物質を冷却し、液体に戻し、再び反応系に戻す化学的な手法のことをいいます。
最後に、有機合成実験において、加熱還流が多用される理由について説明して、この章は終わりにしたいと思います。
理由は、とても簡単で、有機合成実験で使用される物質が、無機合成実験で使用される物質と比べて、沸点が低い物質が多いためです。
なぜ、有機合成実験で使用される物質の方が、無機合成実験で使用される物質と比べて、沸点が低い物質が多いかというと、有機化合物は分子結晶が多く、無機化合物はイオン結晶が多いためです。
4、常圧蒸留

まず、常圧蒸留の原理について説明します。
常圧蒸留とは、混合物の沸点の差を利用して液体を分離する手法のことです。
今回は、加熱還流によって得られた無水エタノールの不純物を取り除くことを目的に使用されています。

常圧蒸留は通常、上図のような装置を用いて行います。
まず、左側の丸底フラスコの加熱を行うと温度計の温度は上昇し続け、リービッヒコンデンサー(リービッヒ冷却管)によって冷却された気体は液体となって三角フラスコに回収されます。このときに回収された液体は、微量に含まれる不純物(今回の実験の場合は、エタノール以外の不純物のこと)になります。この液体を初留といい、不純物の液体になります。
次に、温度計の温度が一定になります。これが分離を目的とした物質になります(今回の実験では、大多数がエタノールなので78 ℃前後で温度が一定になります)。これを本留といい、回収したい物質になるので、初留とは違う三角フラスコで回収する様にしましょう。
最後に、混合物中に目的とする物質が無くなると、温度計の温度が上昇を始めます。これは、目的とする物質よりも沸点が高い不純物が蒸発していることを意味しています。ですので、目的とする物質の沸点から更に温度計の温度が上昇した場合に、蒸留操作を終了します(今回の実験では、78 ℃から上昇を始めたら蒸留の操作を終了します)。ここで得られた液体を終留といい、不純物を含むので、本留とは別の三角フラスコで回収します。
この章の最後に、常圧蒸留の特殊なケースを説明します。
通常は、上図のようにリービッヒコンデンサーを、三角フラスコ側の口を少し下げて、横の状態にしますが、下図のように冷却管を縦にして蒸留を行うことがあります。この理由について、説明していきます。

上図のような冷却管を縦にした常圧蒸留装置は、ジエチルエーテル(沸点:34.6 ℃,引火点:-45 ℃)のような低沸点引火性物質の蒸留に利用されます。
通常のリービッヒコンデンサーは下から上に水を流して使用ますが、縦に使用するジムロートコンデンサーは上から下に水を流して使用します。また、上図から分かるように渦を巻いて水が流れるので、表面積が大きくなります。そのため、気体との接触面積が増えて、効率的に冷却することができます。また、上から水を流すため、最も冷たい水が、最も気体が存在する丸底フラスコと冷却管の接合部付近に流れるため、これも効率的な冷却を助けます。
つまり、低沸点引火性物質の蒸留の際には、冷却効率の高いジムロートコンデンサーを使うことで効率的に蒸留し、気体の過剰な加熱を避けることで、引火の危険性を減らしています。また、冷却管を縦にすることで回収される液体と熱源からの距離を離し、引火する危険性を減らしています。
5、屈折率

まず、屈折計について説明する前に、屈折について簡単に説明します。
屈折とは、境界面で波が進行方向を変える現象のことです。もう少し簡単に言うと、上記の写真のように水と空気から見た手の様子が異なっている現象のことを示します。
これは、水と空気で光を反射させる屈折角という角度が異なるためです。この屈折角は、水溶液などの濃度によって変化します。この性質を使用して、溶液の濃度を測定するようにした装置を屈折計といいます。今回の実験で使用されるアッベ屈折計は、プリズムの上に試料を置いて光の屈折の変化を見ることができます。下図のようなイメージです。
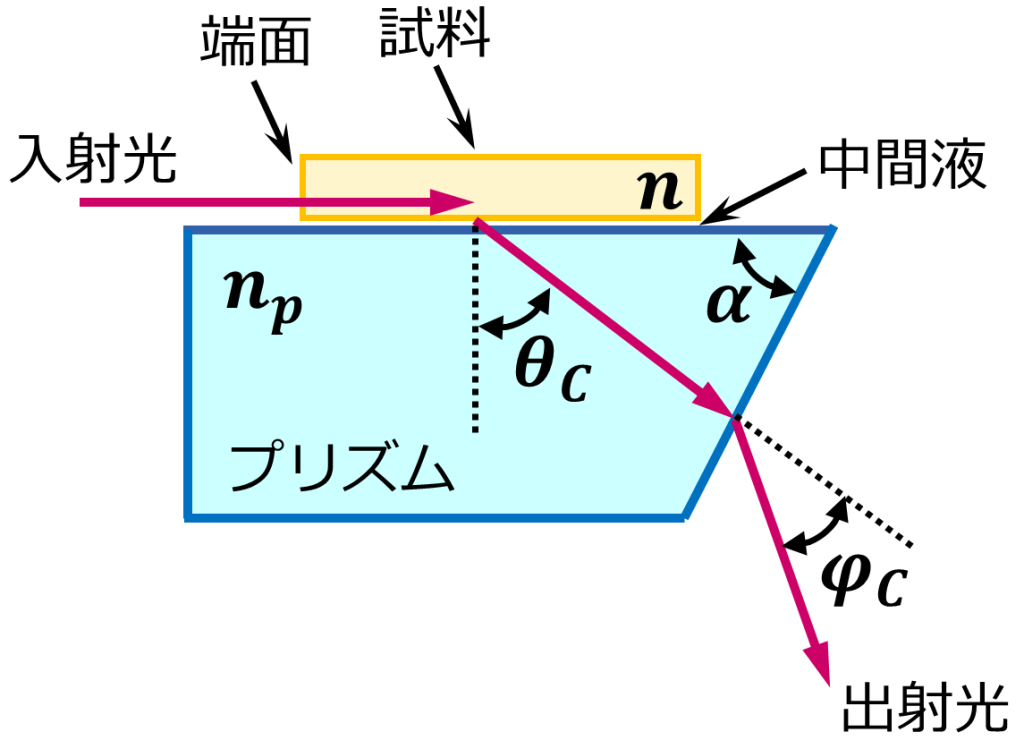
また、使用方法については、測定試料溶液をプリズム上に加え、光が入射する境界線の明暗をレンズから見える「✖」の中心に合わせ、目盛りから屈折率を読み取ります。この屈折率を用いて、純度と屈折率の関係を示すグラフから算出します。
6、~まとめ~
いかがでしたか?
今回は、脱水反応を用いた含水エタノールから無水エタノールを調製する実験を、無水エタノール,脱水反応,加熱還流,常圧蒸留,屈折率の5つのキーワードから説明しました。どの章も重要なのでしっかりと抑えておきましょう。
また、参考文献は以下の通りになります。
1、飯田隆,菅原正雄,鈴鹿敢,辻智也,宮入伸一「イラストで見る化学実験の基礎知識 第3版」2014、p 61,62,154,174~176
最後になりますが、参考文献以外はコピペ厳禁です。バレます。気を付けてください。自分で理解してまとめてください。
今回の記事は以上になります。最後まで読んでいただき、ありがとうございました。





[…] 今回は、以前書いた「脱水反応を用いた含水エタノールから無水エタノールの調製 ~無水エタ…で得られた無水エタノールと酢酸を用いてフィッシャーエステル化反応によって酢酸エチルを合成する実験について解説いたします。 […]