こんにちは、trans(トランス)です。
今回は、強酸と弱酸混合物の電気伝導度滴定の実験について解説していきます。
まず、電気伝導度の章では、実験で使用する薬品の物性,電気伝導度滴定の原理,無限希釈との関係性,中和滴定との差などを説明していきます。
次に、電気伝導率測定セルの章では、電気伝導率測定セル,セル定数などを説明していきます。
実験の予習をやらなければいけないけど時間が無いという学生に向けて予習の手間が省けるように、この記事を書いています。スマホを見ながら電車で予習することもできます。実験項目は某大学の実験テキストを参考にしています。
レベル的には、大学の学部生レベルを想定していますが、高校生も化学の発展的なことが知りたければ読んでいただいて構いません。
それでは行きましょう!
1、電気伝導度

まず、今回の実験で使用する薬品の物性を記載します。
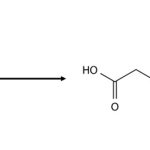
強酸の代表として塩酸,弱酸の代表として酢酸,中和用の塩基として水酸化ナトリウム,中和滴定時の指示薬としてフェノールフタレインを紹介します。参考にしてください。
○塩酸
・化学式:HCl
・モル質量:36.46 g/mol
・外観:無色透明な液体
・融点:濃度に依存
・沸点:濃度に依存
○酢酸
・化学式:CH₃COOH
・モル質量:60.05 g/mol
・外観:無色の液体
・融点:16.7 ℃
・沸点:118 ℃
○水酸化ナトリウム
・化学式:NaOH
・モル質量:40.00 g/mol
・外観:白状固体
・融点:318 ℃
・沸点:1388 ℃
○フェノールフタレイン
・化学式:C₂₀H₁₄O₄
・モル質量:318.32 g/mol
・外観:白または淡黄色固体
・密度:1.277 g/cm(32 ℃)
・融点:258~263 ℃
・変色域:オレンジ(pHが-1以下),無色(pHが0~8.3),ピンク色(pHが8.3~10.0),無色(pHが10以上)
※フェノールフタレイン溶液の変色液は基本的には、pH 8.3~10.0にピンク色,それ以外は無色という理解で問題ないです。
次に、電気伝導度滴定について説明します。
電気伝導度とは、物質がどの程度電気を通すかを表した値のことで、電気伝導率や導電率などとも呼ばれます。
電気伝導度は、物質によって異なります。この物質の電気伝導度の差を利用して行う滴定を電気伝導度滴定と言います。
今回の実験では、酸と塩基の反応に対して、電気伝導度滴定を行っているので、大まかにいうと、H⁺とOH⁻の存在量による電気伝導度を利用して、滴定を行っています。細かい部分は、無限希釈との関係性の項目で、滴定曲線と関連づけて説明するので、そちらを参照してください。
次に、電気伝導度と無限希釈の関係性について説明します。
先ほどの項目で述べたように電気伝導度は物質によって異なりますが、同じ物質であっても濃度によって変化します。
最初は濃度を上げれば上げるほど、電離を起こし、電気伝導度は比例関係で上がります。しかし、ある程度になると電離度が下がり、電気伝導度は頭打ちになり、やがてイオン同士の相互関係によって、電気伝導度は下がっていきます。
ここまでは1つのイオンについて解説をしましたが、基本的な化学系においては複数のイオンが存在し、互いが相互的に作用しています。これら複雑な条件を簡単にするために、1つのイオンが他のイオンの影響を受けないときの伝導度を表現するために、無限希釈におけるイオンのモル伝導率があります。簡単に言うと、濃度(イオンの存在量)が限りなくゼロに近いので、イオン間の影響を受けないということです。つまり、無限希釈であれば、濃度と電気伝導度に比例関係が存在するということです。
これを踏まえて、電気伝導度滴定曲線を見てみましょう(下図参照)。
下図引用:2.1.氷点降下(4人1組)

強酸(HCl)と強塩基(NaOH)の電気伝導度滴定であれば、上図のように綺麗な比例関係が見られます。しかし、弱酸性(CH₃COOH)は綺麗な比例関係が見られません。これは、弱酸が強酸と比べて、電離度(イオンへのなりやすさ)が小さいため、H⁺が中和されるごとに新しいH⁺が電離する状態になります。そのため、電気伝導度は濃度が上がっても低い値で、一定になります。上図が緩やかに上昇しているのは、酢酸のCH₃COO⁻と水酸化ナトリウムのNa⁺が増加しているためです。
弱酸においても、無限希釈であれば電離度は強酸と同等になるので、弱酸であっても強酸と同じような滴定曲線になります。
この章の最後に、電気伝導度滴定と中和滴定の差について説明します。
実は電気伝導滴定と中和滴定で得られる終点は厳密に言うと異なります。
なぜでしょうか?それは終点の判断の仕方です。
電気伝導度滴定は、滴定曲線の変曲点(強酸・強塩基)や傾きが変わった点(弱酸・弱塩基)を終点とします。つまり、電気的に中性になった部分を終点とします。
一方、中和滴定は指示薬が変色したところを終点とします。例えば、フェノールフタレインの変色域は、pH 8.3~10.0ですので、塩基性の部分が終点となります。つまり、厳密に言うと中和点よりも過剰に塩基を加えています。過剰に塩基が加えられるので、電気伝導度滴定の値と比較すると酸の濃度が少し高い結果となります。なぜ、このようなことが起きるかというフェノールフタレインは、pHが8.3以上になるとH⁺が電離し、構造が変化することによって変色するためです。もう少し詳しく知りたい人は、「色のイロイロ」をご覧下さい(少し変色のpHが異なっていますが誤差と考えてください)。
また、強酸と弱酸の混合物における電気伝導度滴定では、「電導度滴定の実験と高等学校」の図13のⅡにあるように、比例関係で下がり、緩やかに上がり、傾きが急激になるという滴定曲線を示します。これによって比例関係での下がりが止まった点が強酸の終点,緩やかな上りから傾きが急激になった点が弱酸の終点となります。中和滴定で混合物の各濃度を求めようとした場合、複数の指示薬を加える等の複雑な操作が必要となりますが、電気伝導度滴定ではあれば、そのような複雑は操作なく、1つの溶液の濃度を求めるときと同様の方法で混合物の濃度を求めることができます。
電気伝導度滴定と中和滴定の差について、上記のような説明を参考に考察すると、より良いレポートが書けると思います。
2、電気伝導率測定セル

セルということで、細胞(Cell)のような画像を貼ってみました(笑)。
まず、電気伝導率測定セルについて説明します。
電気伝導率測定セルとは、2枚の白金黒つき白金電極に電解質溶液を入れた容器のことをいいます。これによって、目的とする溶液の電気抵抗を測定することができます。この電気伝導度を、pHに直したのがpHメーターになります。ですので、電気伝導率測定セルの外観は、pHメーターと同じイメージを持っていただいて構いません。
次に、セル定数について説明します。
電気伝導率測定セルが持つ電極の表面積や電極間の距離は、各電気伝導率測定セルによって異なります。電気伝導率(κ)は、抵抗(R)の逆数に電極間の距離(L)を乗じて、電極の表面積(A)を除した値になります。式に表すと、「κ=L / ( R×A)」となります。
つまり、L/Aが分からなければ、抵抗から電気伝導率に変更するときに正確な値を出すことができません。また、L/Aの値を考慮しなければ、電気伝導率測定セルを変更するたびに、電気伝導率が変わってしまいます。そのため、正確な電気伝導率を求めるためには、L/Aを固有の値として求める必要があります。この値をセル定数といいます。このセル定数は、電気伝導率が分かっている塩化カリウム溶液を用いて抵抗を測定することで求めることができます。
まあ、今回行う電気伝導度滴定は、溶液の電気伝導度の相対的な変化を測定できれば問題ないので、セル定数は参考程度に抑えておきましょう。
3、~まとめ~
いかがでしたか?
今回は、強酸と弱酸の混合物濃度を電気伝導度滴定によって測定する実験を、電気伝導度,電気伝導率測定セルの2つのキーワードから説明しました。どの章も重要なのでしっかりと抑えておきましょう。
また、参考文献は以下の通りになります。
1、飯田隆,菅原正雄,鈴鹿敢,辻智也,宮入伸一「イラストで見る化学実験の基礎知識 第3版」2014、p 113~118
最後になりますが、参考文献以外はコピペ厳禁です。バレます。気を付けてください。自分で理解してまとめてください。
また、完全に情報を網羅しきれていないと思いますので、質問等ありましたら、下のコメント欄にコメントお願いします。
今回の記事は以上になります。最後まで読んでいただき、ありがとうございました。