こんにちは、trans(トランス)です。
今回は、ペルオキソ二硫酸カリウムとヨウ化カリウムを用いて温度変化による反応速度を測定し、活性化エネルギーを求める実験について解説いたします。
まず、反応速度の章では、反応速度測定の原理などについて解説をいたします。
次に、活性化エネルギーの章では、本実験での活性化エネルギーの求め方や気相反応の衝突理論での解釈について説明いたします。
実験の予習をやらなければいけないけど時間が無いという学生に向けて、予習の手間が省けるように、この記事を書いています。スマホを見ながら電車で予習することもできます。実験項目は某大学の実験テキストを参考にしています。
レベル的には、大学の学部生レベルを想定していますが、高校生も化学の発展的なことに興味があれば、読んでみてください。
それでは行きましょう!
1、反応速度

今回の実験では、以下の二つの反応を利用しますので、そこからご説明いたします。
S2O82-+2I–→2SO42-+I2 …①
I2+2S2O32-→2I-+S4O62- …②
ペルオキソ二硫酸イオン(S2O82-),ヨウ化物イオン(I–),チオ硫酸イオン(S2O32-)が溶液中に混在するとき、反応の競争が起きます。
このとき、反応式②は、反応式①に比べて極めて速いです。すなわち、反応式②の反応が終わるまでI2は存在できないことが分かると思います。
ここで、反応系中にデンプンを加えておけば、ヨウ素デンプン反応によりI2の存在を褐色の呈色を持って確認することができます。つまり、この呈色が、S2O32-をすべて消費したことを意味しています。
ここまでの内容を踏まえると、S2O82-,S2O32-,デンプンが共存する溶液に、I-を加えてからヨウ素デンプン反応による褐色に呈色されるまでの時間は、反応式②が終了するまでに有した時間であるということができます。
これを利用すると、以下に示す2つのことができ、この2つによって反応速度式を決定することができます。
1つ目について説明いたします。
S2O82-の初濃度を[S2O82-]0,I-の初濃度を[I-]0,S2O32-の初濃度を[S2O32-]0とします。
[S2O82-]0,[I-]0は一定として、[S2O32-]0を変えて測定を行います。
呈色までに消費されたS2O82-の濃度は、[S2O32-]0の濃度によって決定されるので、呈色までの時間と、[S2O82-]0の減少量から以下のような反応速度vの式が定義できます。
v=-d[S2O82-]/dt
上記の式により[S2O82-]の変化と呈色までの時間から反応速度を求めることができます。
これにより、[S2O82-]の時間変化の対数値と、呈色までの時間をプロットしてv=a[S2O82-]を示すことができ、このときのaは比例定数です。
2つ目について説明いたします。
[S2O82-]0と[S2O32-]0を一定にして、[I-]0を変えて測定を行います。
[S2O82-]0の減少量は、[S2O32-]0によって決まるため、ここでは[S2O82-]0の減少量は一定であるといえます。
すなわち、[S2O82-]0の減少量を呈色までの時間で割った値は、このときの平均の反応速度v0であるとみなせます。
ここで、[I-]0を変化させていて、実験結果から反応速度と[I-]0の変化による関係式を導くと以下のようになります。このときのbは比例定数です。
v0=b[I–]2
1つ目と2つ目の関係から、aをそのときの[I–]2で割った数値と、bをそのときのペルオキソ二硫酸イオンの平均濃度[S2O82-]av(=(2[S2O82-]+Δ[S2O82-])/2)で割った値を比較すると以下のようになります。
a/[I–]2=b/[S2O82-]av=k
このときのkは反応速度定数と呼ばれ、反応速度vと反応物質には以下の関係が得られます。
v=k[I–]2[S2O82-]
2、活性化エネルギー

まず、本実験での活性化エネルギーの求め方についてご説明いたします。
反応速度は、[S2O82-]0,[S2O32-]0,[I-]0が一定の場合、反応系の温度により変化します。
つまり、v0=k[I–]2[S2O82-]avにより反応速度定数の変化を見ることができます。
また、温度と反応速度定数kの間に、アレニウスの式(下に記載、E:活性化エネルギー、R:気体定数、T:絶対温度、k∞:頻度因子)
k=k∞exp(-E/RT)
が成り立つならば、lnkと103/Tをプロットすると直線が得られるので、このことを利用すると、反応の活性化エネルギーを求めることができます。
次に、気相反応の衝突理論における活性化エネルギーの解釈についてご説明いたします。
気相反応の衝突理論での速度定数は衝突の頻度とエネルギーの2つに依存することが予想されます。
この理論における活性化エネルギーの解釈は、エネルギー的側面によってなされるので、二分子間反応について考えると、衝突軸に沿った2分子の並進エネルギーの和が、あるエネルギーの値(以後Ea)よりも大きいときに、化学反応が起こると仮定します。
Eaよりも大きいエネルギーEを持つ分子対の分率をボルツマン分布によって求めると以下のようになります。
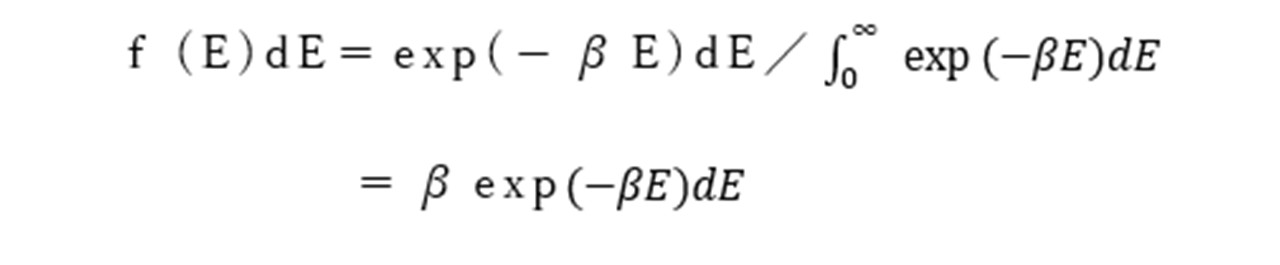
このβは1/kTであるので、Eaよりも大きいエネルギ-を持つ分子対は以下のようになります。
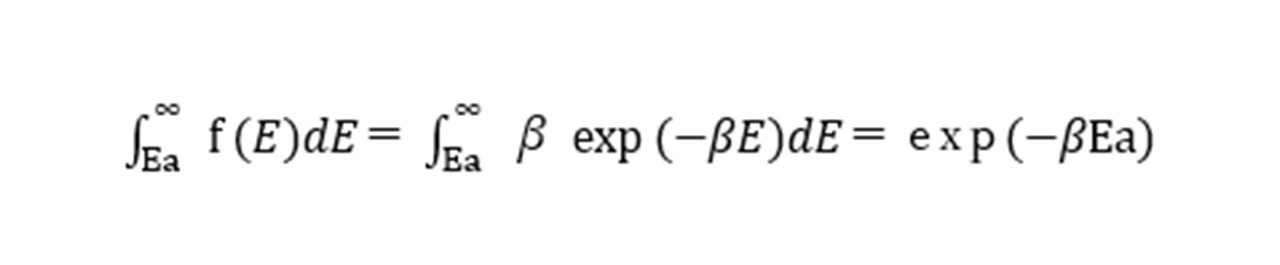
また、この反応における速度定数は、
k=k’exp
=NAπd2AB<vAB>exp(βEa) …③
このときのNA:アボガドロ数、πd2AB:衝突断面積、<vAB>:AおよびBの平均の相対的な速さ
③式は、以下の式でも示されます。
k=Aexp(-Ea/RT)
Aは衝突頻度、Rは気体定数、Tは絶対温度であるから、この式はアレニウスの式になっていることが分かります。
すなわち、このEaは活性化エネルギーであります。以上のようなことから、気相反応の衝突理論での活性化エネルギーは、反応を起こすために必要な衝突のエネルギーであると解釈できます。
3、~まとめ~
いかがでしたか?
今回は、ペルオキソ二硫酸カリウムとヨウ化カリウムを用いて温度変化による反応速度を測定し、活性化エネルギーを求める実験について、反応速度,活性化エネルギーという2つのキーワードから説明しました。どの章も重要なのでしっかりと抑えておきましょう。
また、参考文献は以下の通りになります。
1、アトキンス 物理化学(下) 第10版,東京化学同人,20章・21章
最後になりますが、参考文献以外はコピペ厳禁です。バレます。気を付けてください。自分で理解してまとめてください。
また、完全に情報を網羅しきれていないと思いますので、質問等ありましたら、下のコメント欄にコメントお願いします。
今回の記事は以上になります。最後まで読んでいただき、ありがとうございました。