こんにちは、trans(トランス)です。
今回は、4-メチルシクロヘキサノンの還元から4-メチルシクロヘキサノールを合成し、合成した4-メチルシクロヘキサノールをガスクロマトグラフィー,赤外線吸収スペクトル,マススペクトル,¹H-NMRスペクトルによって分析する実験について解説いたします。
まず、還元反応の章では、アルデヒドやケトンの還元法や還元剤などについて解説をいたします。
次に、減圧蒸留の章では、原理や使用方法について解説いたします。
次に、分析機器の章では、赤外線吸収スペクトル,マススペクトル,¹H-NMRスペクトルの原理や使用方法について解説いたします。
最後に、実験操作の章では、本実験で注意するポイントや収率の算出方法などを解説いたします。
実験の予習をやらなければいけないけど時間が無いという学生に向けて、予習の手間が省けるように、この記事を書いています。スマホを見ながら電車で予習することもできます。実験項目は某大学の実験テキストを参考にしています。
レベル的には、大学の学部生レベルを想定していますが、高校生も化学の発展的なことに興味があれば、読んでみてください。
それでは行きましょう!
目次
1、還元反応

ポイント還元ということで、この写真をトップ画像に使ってみました(笑)。
それでは、気を取り直して、本題に行きましょう。
アルデヒドやケトンを還元するとアルコールを得ることができます。
アルデヒドやケトンを還元する方法は多くありますが、今回は代表的な6つの還元方法についてご紹介いたします。
1‐1、ヒドリド還元
ヒドリド還元とは、物質の還元を求核剤としてヒドリド(H⁻)を用いる還元方法ことです。
代表的なヒドリド還元剤としては、水素化ホウ素ナトリウム(NaBH₄)と水酸化アルミニウムリチウム(LiAlH₄)が上げられます。
水酸化アルミニウムリチウム(LiAlH₄)は、非常に還元性が強く、ほとんどのカルボニル化合物(C=O)に作用します。
一方、水素化ホウ素ナトリウム(NaBH₄)は、アルデヒドとケトンと特異的な還元します。そのため、アルデヒドやケトンを還元する場合は、基本的には水素化ホウ素ナトリウム(NaBH₄)が使用されます。
本実験もケトンである4-メチルシクロヘキサノンを、水素化ホウ素ナトリウム(NaBH₄)によってヒドリド還元して、4-メチルシクロヘキサノールを合成しています。以下に本実験の反応機構を示します(見やすくするためにNa⁺を省略しています)。
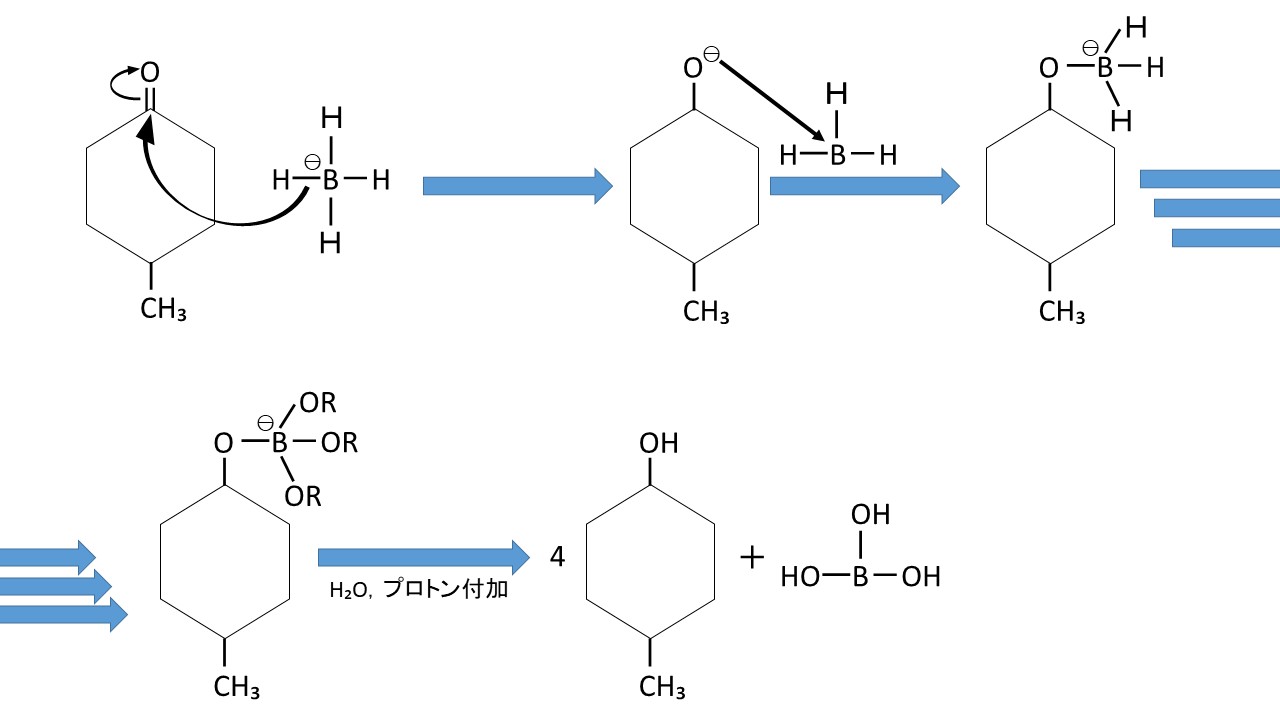
まず、水素化ホウ素ナトリウムのホウ素と水素の結合電子が、4-メチルシクロヘキサノンのカルボニル基へ攻撃を仕掛けることで、二重結合が立ち上がります(上図左上)。
次に、4-メチルシクロヘキサノンの酸素が持つ電子が、不安定な状態にある水素化ホウ素ナトリウムのホウ素に攻撃を仕掛けます(上図中上)。
ヒドリドは3つ残っているので、同様の反応が3回起こります(上図右上→上図左下)。ちなみに4-メチルシクロヘキサノンの六員環とメチル基は複雑になるので、“R”として省略しています。
最後に、プロトン付加して加水分解することで、4つの4-メチルシクロヘキサノールとホウ酸を得ることができます(上図中下)。
1‐2、シラン還元
シラン還元とは、ケイ素の水素化物を使用した還元方法で、カルボニル基をアルコールもしくはメチレンまで還元するのに利用されます。アルデヒドやケトンからアルコールを得る場合には、ヒドリド還元の方が一般的です。
特にトリエチルシランは、汎用性の高い還元剤として、広く利用されています。
例として、アセトンがトリエチルシランによって、ヒドロシリル化する反応を以下に示します。
CH₃ーC(CH₃)=O + HSi(C₂H₅)₃ → CH₃ーCH(CH₃)ーOーSi(C₂H₅)₃
1‐3、有機スズ化合物による還元
有機スズ化合物は、ハロゲンを水素に還元したり、アルケンやアルキンへヒドロスタニル化するときに用いられます。
特に、トリブチルスズが還元剤として利用されます。
例を示して解説したかったのですが、トリブチルスズの嵩高さとラジカル機構によって生じる複雑な還元反応ですので、今回は反応式の記載は省略いたします。
具体的な反応式を用いて説明できる人がいれば、是非、教えてください。
1‐4、接触還元法
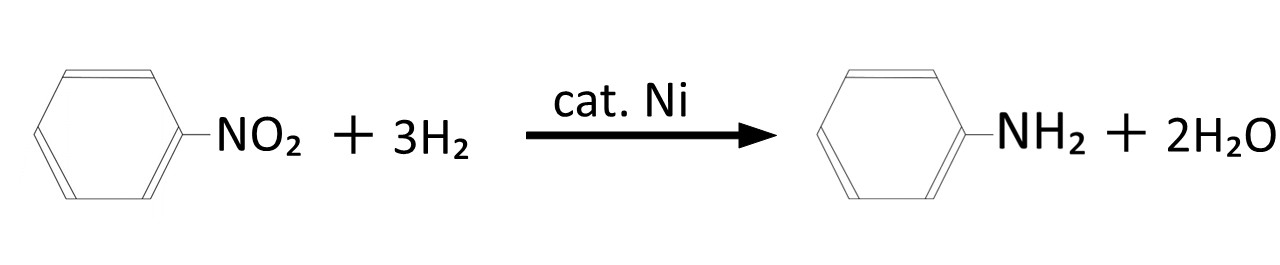
接触還元法とは、金属系の水素雰囲気下で水素還元することができる触媒を用いて行う還元反応のことです。
還元剤は水素ですので少し話が変わるかもしれませんが、接触還元法で用いられる代表的な触媒としては、ニッケル,銅,Pd/Cなどが上げられます。
例として、ニトロベンゼンをアニリンへ還元する反応を以下に示します。
1-5、ウィルキンソン触媒
ウィルキンソン触媒とは、ロジウム(Rh)の周りに3つのトリフェニルホスフィン(Ph₃P-)と1つの塩素が結合したRhCl(Ph₃P)₃という構造式で表されるオレフィンに対して使用される還元剤です。
Pd/Cを用いた接触還元法とは異なり、カルボニル基やニトロ基を還元しない特徴があります。
こちらも残念なことに複雑な化合物が多く、物質名が分かりませんでしたので、記載を省略いたします。具体的な物質名は上げられませんが、オレフィンの持つ二重結合が水素化し、単結合に変わる還元反応が起こります。
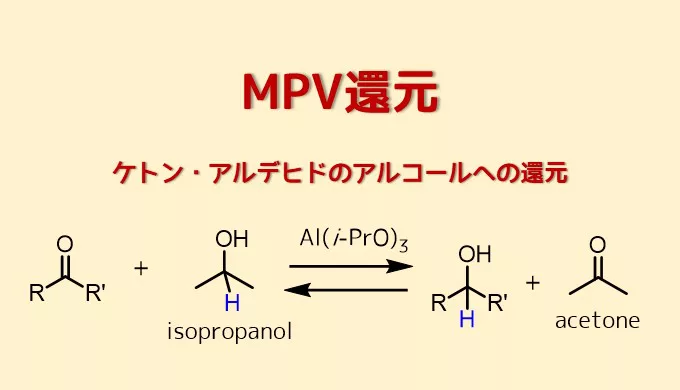
1-6、MPV還元
MPV還元とは、メーヤワイン・ポンドルフ・ヴァーレイ還元の略で、アルミニウムアルコキシドとイソプロパノールを用いて、ケトンをアルコールに還元する方法のことです。
アルミニウムアルコキシドが触媒として、イソプロパノールが還元剤として機能します。また、アルミニウムアルコキシドには、アルミニウムイソプロポキシドが良く用いられます。
一般式にはなりますが、ケトンをMPV還元によって還元するときの反応式を以下に示します。
2、減圧蒸留

まず、減圧蒸留の原理について、説明いたします。
液体の蒸気圧は、加熱によって温度とともに上昇します。この蒸気圧が大気圧以上になると内部からも蒸発が起き、液体は沸騰します。すなわち、蒸気圧が系内の気圧以上になると沸騰が起きます。これを言い換えると、系内の圧力を大気圧以下にすると、沸点が下がるということです。この原理を利用して、系内を減圧し、通常よりも低い温度で行うことのできる蒸留を減圧蒸留といいます。
利点としては、常圧では沸点が高い物質の低温での蒸留を可能にしたり、熱分解しやすい不安定な液体物質の蒸留を可能にすることができる点です。
高沸点物質の例としては、ベンズアルデヒド(bp178℃/760mmHg)、ジメチルアニリン(bp194℃/760mmHg)などが挙げられます。ベンズアルデヒドは、安価な香料,抗炎症剤として利用されています。ジメチルアニリンは、有機化合物の前駆体,エステル成型の促進剤として利用されています。
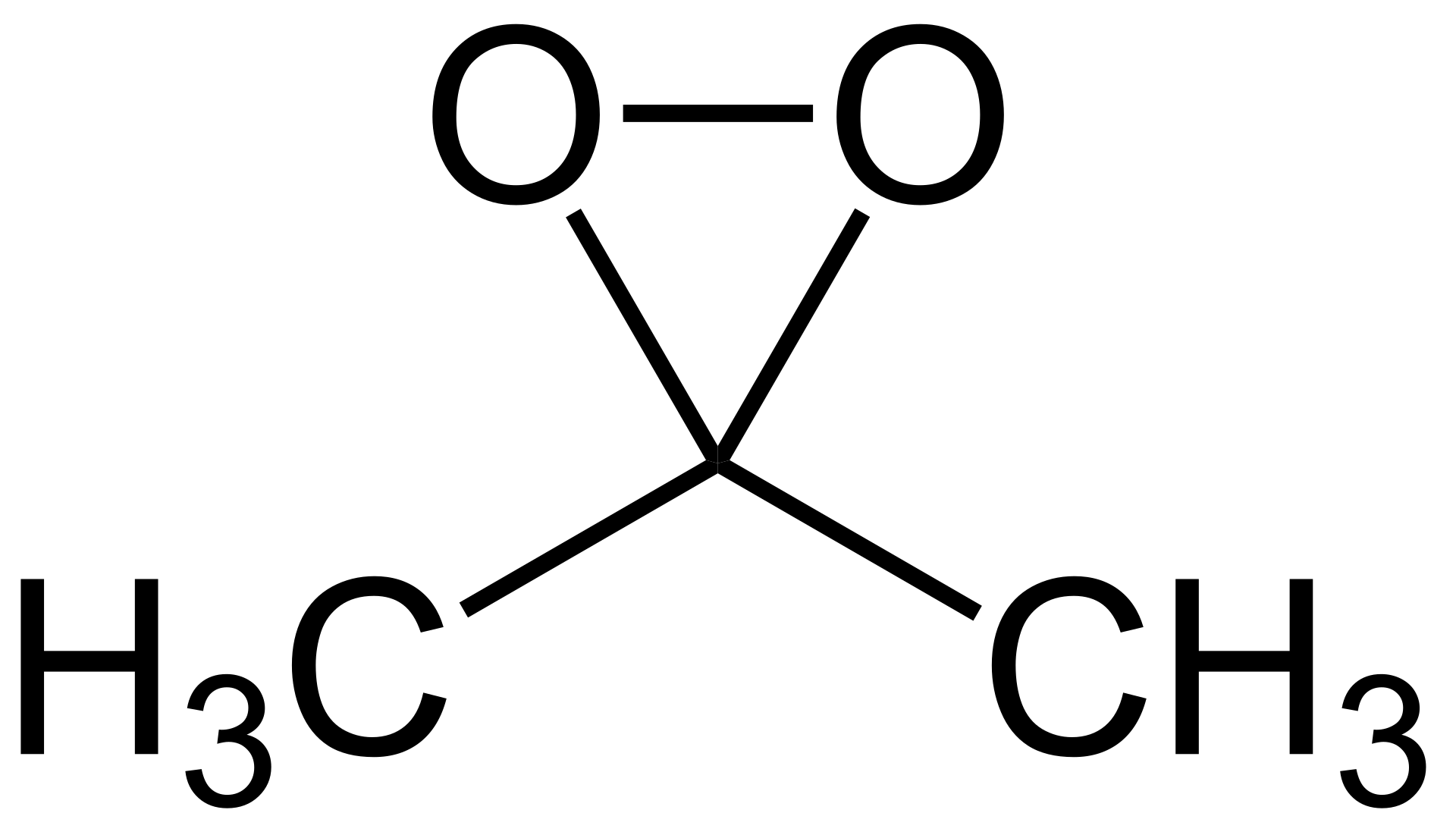
熱分解しやすい不安定な液体物質の例としては、ジメチルジオキシラン,クメンヒドロペルオキシドなどが上げられます。ジメチルジオキシランの構造は以下の通りです。
上記の構造式から分かるように、三員環構造と-O-O-結合が存在します。三員環構造は不安定であり、-O-O-結合は結合エネルギーが小さいため低い温度で熱分解されやすい性質があります。
ちなみに、-O-O-結合が離されるとアセトンとなり安定な化合物になるため、ジメチルジオキシランは強い酸化剤として利用されます。
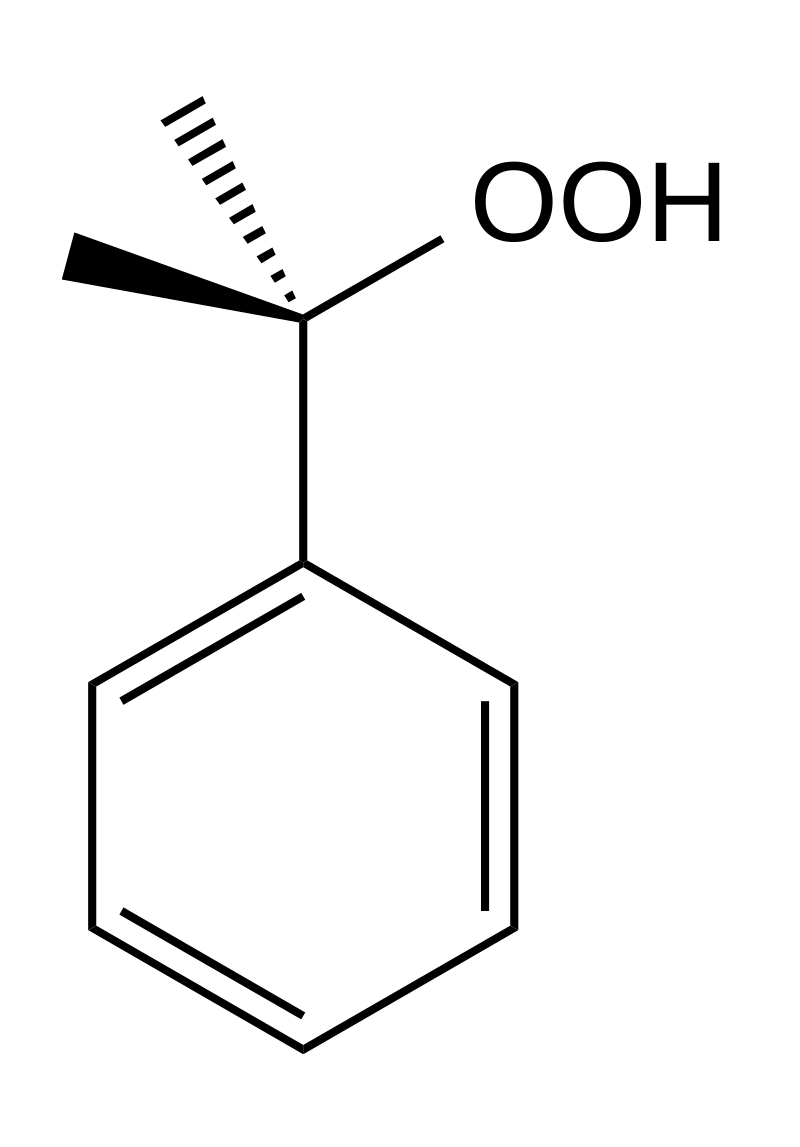
また、クメンヒドロペルオキシドの構造は以下の通りです。
上図から分かるようにジメチルジオキシラン同様、-O-O-結合が存在します。
このような有機過酸化物は、-O-O-結合の結合エネルギーが小さいため低い温度で熱分解されやすいです。また、クメンヒドロペルオキシドは79 ℃以上で爆発、150 ℃以上で分解される性質を持ちます。
また、クメンヒドロペルオキシドは強い酸化剤として利用されたり、クメン法の中間体であるなど工業的需要はかなり高いです。
次に、減圧蒸留の使用方法について、説明いたします。
蒸留は、一般的に目的成分の沸点を調べ、その沸点付近で取り出される物質を得ます。すなわち、減圧蒸留においては、減圧下での沸点を知る必要があります。
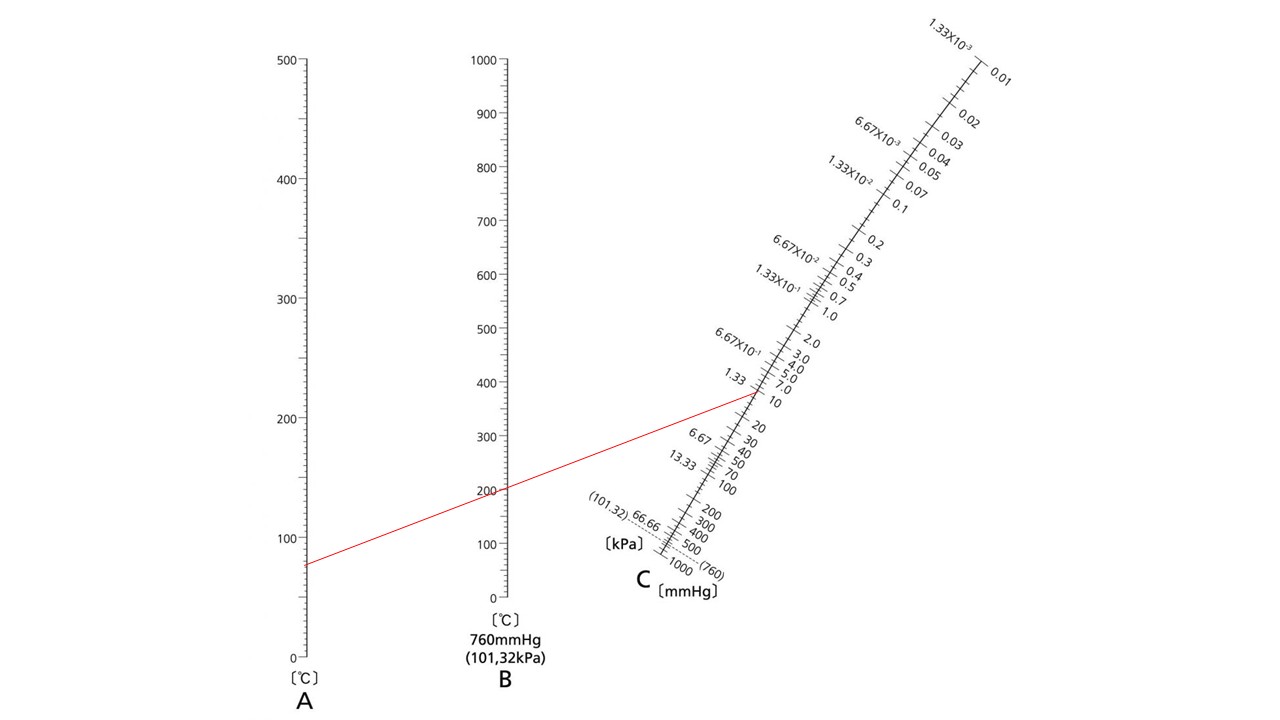
それを知るために用いるのが沸点換算図表です。
これらの理由から、減圧蒸留装置の組み立て方や使用方法,操作方法を説明する前に、以下の沸点換算図表を用いて、沸点換算図表の使い方を説明します。
引用・編集:https://www.cnreagent.com/show1000005/technical_223.html
上図のAは減圧時の沸点,Bは常圧時(760mmHgまたは101.32Kpa)の沸点,Cは減圧度(減圧したときのmmHgまたはKpa)を示します。
この3つのうち2つが分かれば残りの1つを算出することができます。
もう少し詳しく説明すると、分かっている2点を直線で結び、その直線と交わるところが残りの1つの値になります。
例えば、760mmHg(101.32Kpa)で沸点が200℃の物質が、10mmHg(1.33Kpa)で沸点が約75℃ということが分かります。
ただし、この図表は非会合性液体におけるものであり、概略的な値であるので注意が必要です。
ここからは、減圧蒸留装置の組み方や、使い方について説明します。減圧蒸留には、ミクロ常圧蒸留,エバポレーター,分子蒸留,水蒸気蒸留など特別なものもありますが、ここでは一般的な減圧蒸留について説明いたします。
減圧蒸留装置を以下の通りです。
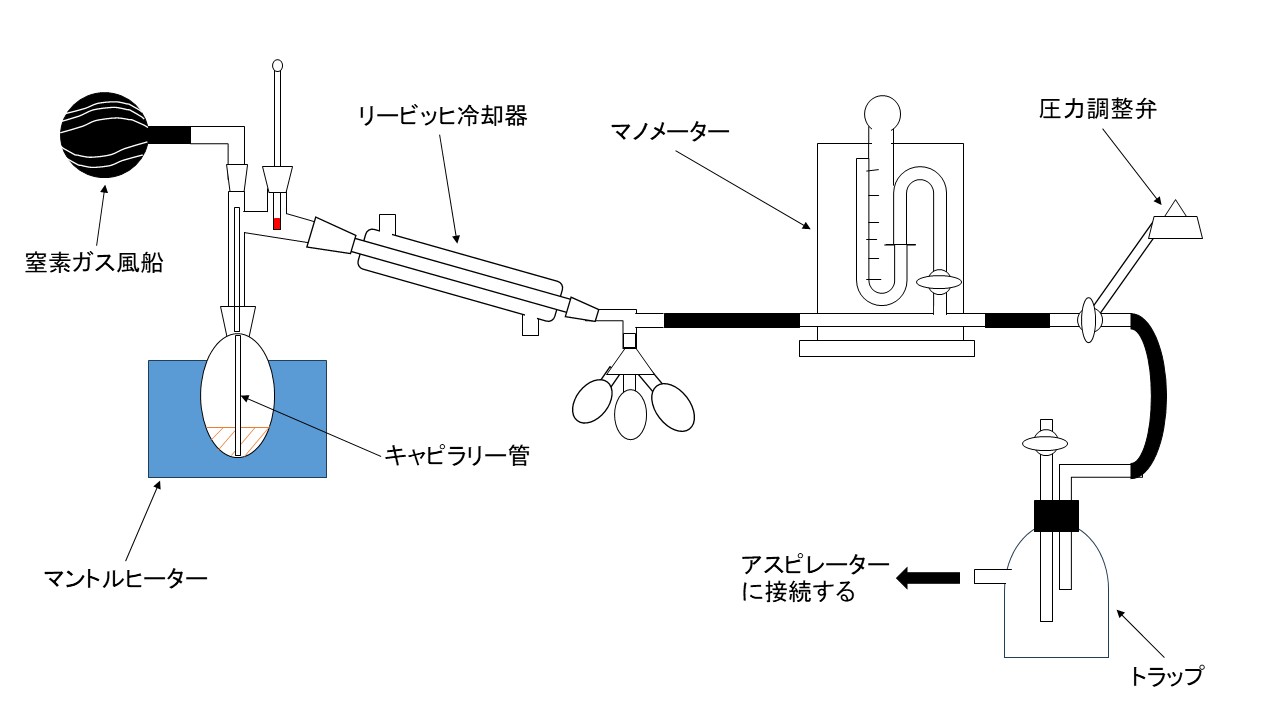
上図のキャピラリー管と窒素ガス風船の役割について説明いたします。
まず、キャピラリー管の役割について説明いたします。
常圧蒸留においては突沸を防ぐために沸騰石を用いるが、減圧蒸留においては、激しく突沸し沸騰石を用いても意味がなくなります。そのため、キャピラリー管を通して細かい気泡を連続して放出することで、突沸を防いでいます。ここで重要な事は、キャピラリー管の先端をできるだけ細くして、先端がフラスコの底に届く長さになるように作成することです。
次に、窒素ガス風船の役割について説明いたします。
有機化合物は、酸化や加水分解をしやすいものが多いです。すなわち、酸素や水といった物質と反応をさせないためです。ただし、これらの物質との反応がないものは、キャピラリーの上部にピンチコックとゴム管を取り付ける形でも問題ありません。
ここからは、上図の装置を組み立てた後の使い方について説明いたします。
①キャピラリー管の性能について確かめます。確かめる方法としては、アスピレータ―を起動させた時に、気泡が連続的に出ていることを確認します。
②キャピラリー管の性能に問題がなければ、圧力調整弁を用いて適当に真空度を低下させ、減圧度を調整します。
③沸点換算図表を利用してマノメーターから読み取れる減圧度、あらかじめ調べておいた常圧の沸点から、減圧蒸留時の沸点を予測しておきます。マノメーターは減圧されるほど水銀が膨張し、メモリが上昇します。そのため、沸点換算表のC(減圧度)は上に行くほど小さな値になっています。ちなみに本実験で合成する4-メチルシクロヘキサノールの常圧での沸点は、171~173 ℃です。あとは、その沸点に注意しながら常圧蒸留と同じ要領で、初分留、主分留と分離をしていきます。
④減圧蒸留を終えるときは、トラップのコックを開け、アスピレーターを止めて、常圧に戻してから終えるように注意してください。このときマノメーターの値にも注意することが大切です。
3、分析機器

本実験では、ガスクロマトグラフィー,赤外線吸収スペクトル,マススペクトル,¹H-NMRスペクトルの分析機器を使用して、4-メチルシクロヘキサノールを分析しています。
ガスクロマトグラフィーについては、「カラムクロマトグラフィーによる銅イオンと亜鉛イオンの分離 ~カラムクロマトグラフィー,実験操作,データ分析~」という記事で説明したので、今回は赤外線吸収スペクトル,マススペクトル,¹H-NMRスペクトルの3つについて解説いたします。
3-1、赤外線吸収スペクトル
分子を構成している原子は、規則的に絶えず振動しています。
振動するにはエネルギーが必要で、このときに吸収されるエネルギーが赤外線領域に対応している光なので、得られるスペクトルを赤外線吸収スペクトルと呼んでいます。
この振動は原子間のエネルギーによって変化するので、官能基ごとに特異的な赤外線吸収スペクトルをとります。この性質を利用して、目的物質が持つ官能基の特徴を把握することができます。
今回の実験の4-メチルシクロヘキサノンから4-メチルシクロヘキサノールの変化であれば、ヒドロキシ基のO-H伸縮(波数:3,600 ν/cm⁻¹)が確認されなくなり、カルボニル基のC=O伸縮(波数:1,700 ν/cm⁻¹)が確認されるような特徴が見られます。
3-2、マススペクトル
マススペクトルとは、測定したい分子をイオン化させ、その分子を真空中で電磁場かけ分子が受ける影響の差によって現れるスペクトルによって質量を分析する方法のことです。
まず、目的試料を分子化させる方法ですが、高エネルギーの電子を衝突させ陽イオンを発生させる電子イオン化法が一般的です。この他に、化学イオン化法,エレクトロスプレーイオン化法,ナノエレクトロスプレーイオン化法,大気イオン化法などがあります。
この陽イオンにイオン化された目的試料を真空中でマイナスに電荷したフィルムに向かわせる途中に電磁場をかけます。すると移動途中のイオンは磁場の影響を受けて曲がります。この曲がり幅は、イオン化された目的試料が重ければ小さく、軽いほど大きいです。
このように分けられたイオンが質量別にマイナスに電荷したフィルムに印加されることになります。
観測されたスペクトルの中で最も高いピークをベースピークと言い、分子量を示してます。
しかし、フラグメンテーションという現象にも注意が必要です。
フラグメンテーションとは、イオン化されたときの余りのエネルギーが分子内の弱い結合を切断(開裂)させることです。さきほど述べたように、マススペクトルは、ベースピークによって分子量を測定しますが、フラグメンテーションが起こるとピークを与えない恐れがあります。
本実験では、分子量の110付近ではなく、フラグメンテーションによって、55付近に最も高いピークが見られます。
しかし、このフラグメンテーションによって有機化合物の官能基(構造)や性質を調べることが可能ですので、この現象を頭に入れてマススペクトルの解析を行うことが重要となってきます。
3-3、¹H-NMRスペクトル
NMRとは、原子核の持つ磁気エネルギーを検出する方法で、原子の数や種類,位置,隣接する原子や官能基によって特有のNMRスペクトルを示します。この違いを用いて有機化合物の構造決定をすることに利用されます。
NMRは原子核の持つ磁気エネルギーを検出するので、当然、核スピンのスピン量子数が0以外でなくてはなりません。つまり、陽子と中性子の数が共に偶数であると測定できません。以上の理由から、有機化合物の中心的な物質である炭素のNMRスペクトルは、存在比が99%の12Cではなく、1%の13Cを用いる必要があります。
今回は水素のスペクトル(¹H-NMRスペクト)について解説するので、この点は気にする必要はありません。
先ほど説明したように、水素における隣接する原子や官能基の特有のNMRスペクトルは化学シフトによって判断することができます。
化学シフトは、さまざまな位置の水素シグナルと基準シグナルの磁気共鳴周波数(Hz)の差によって表されます。ただし、化学シフトの単位はppmで示します。
基準シグナルとして用いられる物質は、(CH3)4Si(テトラメチルシラン)が多いです。この理由として、4つのメチル基が等価であるため1本のピークのみ得られること,4つのメチル基の中心元素であるケイ素は炭素よりも電子供与体であるため高磁場に現れること,沸点が27.5℃と低いため揮発等で取り除くのが容易なことなどが上げられます。
これまで説明した化学シフトは、以下の式で示される。

すなわち、基準シグナルとして用いられる物質(高磁場)の化学シフトは0となり、化学シフトが大きいほど低磁場になることが分かります。また、化学シフトは測定した磁場によって、270 MHzでは1 ppm=270 Hz、500 MHzでは1 ppm=500Hzというようなスペクトルになります。また、1H-NMRは0~12 ppmの値をとります。
今回の実験ではヒドロキシ基が持つ水素が水素を持たないカルボニル基に変化しますので、高磁場側から低磁場側にシフトピークが移動することを確認することができます。
4、実験操作

今回の実験では、水素化ホウ素ナトリウム(NaBH₄)で4-メチルシクロヘキサノンをヒドリド還元したあとに、コンゴーレッド紙が完全に色調変化するまで、塩酸を加えるという操作があります。まずは、この理由について説明していきます。
コンゴーレッド紙とは、酸性側で変色が起きる試験紙です。
水素化ホウ素ナトリウム(NaBH₄)がアルカリ性であるため、塩酸と中和反応させれることで過剰に残った水素化ホウ素ナトリウム(NaBH₄)を取り除くことができます。この指標としてコンゴーレッド紙が使用されます。
ちなみに以下の反応によって、中和がされています。
4NaBH₄ + 2HCl + 7H₂O → Na₂B₄O₇ + 2NaCl + 16H₂
この時に生じるホウ砂(Na₂B₄O₇)が白色沈殿として確認されます。
次に、収率の算出方法について、ご説明いたします。
11.2 g(0.1 mol)の4-メチルシクロヘキサノン(モル質量:112 g/mol)から4-メチルシクロヘキサノール(モル質量:114 g/mol)を合成したとすると、理論収量は、11.4 gとなります。
したがって、収率は収量を11.4で割り、100を掛けた値で算出することができます。
最後の合成された4-メチルシクロヘキサノールのシス/トランス比の求め方について、ご説明いたします。
まず、大前提ですが、4-メチルシクロヘキサノールは、メチル基とヒドロキシ基の位置関係によってシス体とトランス体に分けられ、合成時は両者が混在しています。
ちなみに、シス体とトランス体は以下のイメージです。
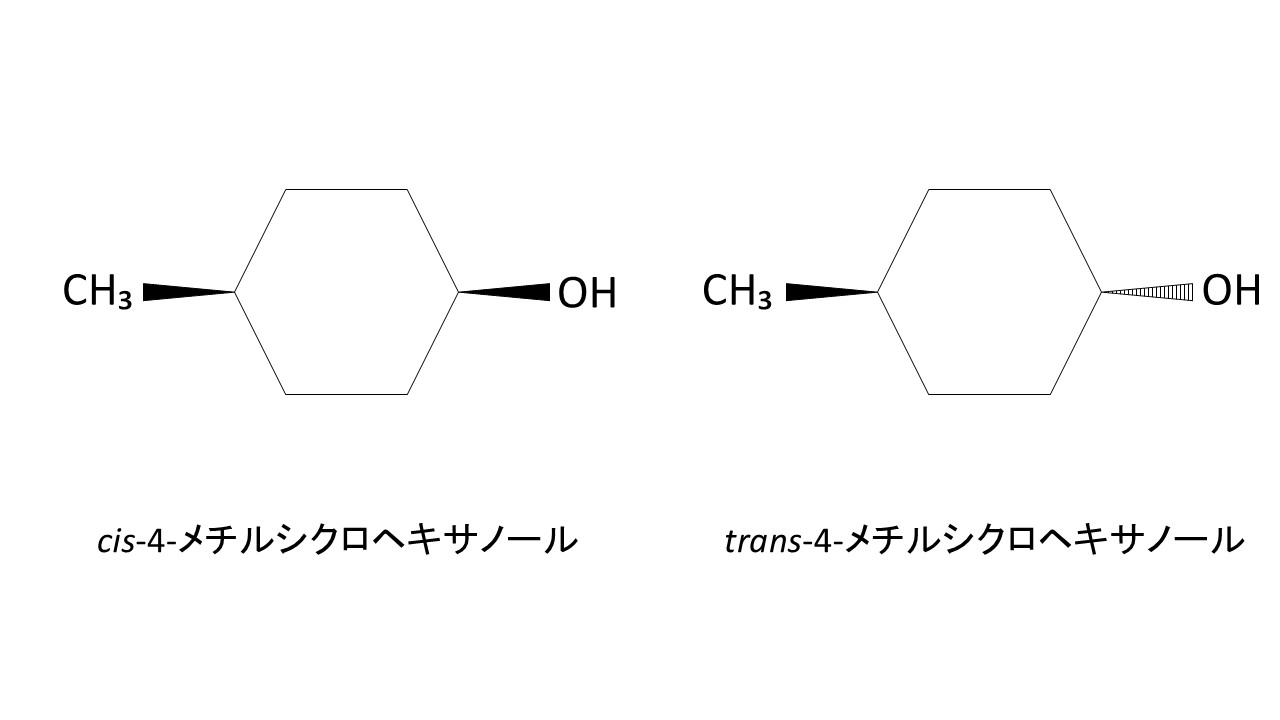
シス体の方が立体的で、トランス体の方が直線的な構造であることが、上図から分かると思います。
両者をカラムに通した場合、立体的なシス体の方が保持時間が長く、直線的なトランス体の方が保持時間が短くなります。この違いを利用して、クロマトグラムの面積比からシス/トランス比を求めることができます。
5、~まとめ~
いかがでしたか?
今回は、4-メチルシクロヘキサノンの還元から4-メチルシクロヘキサノールを合成し、合成した4-メチルシクロヘキサノールをガスクロマトグラフィー,赤外線吸収スペクトル,マススペクトル,¹H-NMRスペクトルによって分析する実験について、還元反応,減圧蒸留,機器分析,実験操作という4つのキーワードから説明しました。どの章も重要なのでしっかりと抑えておきましょう。
また、参考文献は以下の通りになります。
1、飯田隆 他「第3版 イラストで見る化学実験の基礎知識」丸善出版,2009年,p 176~177,203~205,224~227
最後になりますが、参考文献以外はコピペ厳禁です。バレます。気を付けてください。自分で理解してまとめてください。
また、完全に情報を網羅しきれていないと思いますので、質問等ありましたら、下のコメント欄にコメントお願いします。
今回の記事は以上になります。最後まで読んでいただき、ありがとうございました。