こんにちは、trans(トランス)です。
今回は、ブロモクレゾールグリーン(以下:BGC)のpHに対する吸光度変化を測定し、BGCの酸解離定数を求める実験について解説いたします。
まず、BGCの章では、ブロモクレゾールグリーンの化学定数や構造などについて解説をいたします。
次に、実験操作の章では、分光光度計の原理や分光光度法を用いて酸解離定数を求める方法について説明いたします。
最後に、緩衝溶液の章では、緩衝溶液の緩衝能について説明いたします。
実験の予習をやらなければいけないけど時間が無いという学生に向けて、予習の手間が省けるように、この記事を書いています。スマホを見ながら電車で予習することもできます。実験項目は某大学の実験テキストを参考にしています。
レベル的には、大学の学部生レベルを想定していますが、高校生も化学の発展的なことに興味があれば、読んでみてください。
それでは行きましょう!
1、BGC

まず、BCGの物理定数および物性を以下に示します。
・分子式:C21H14Br4O5S
・分子量:698.02
・融点:218~219℃
・外見:黄白色または淡紅色
・液性:アルカリ性水溶液
・酸解離定数:pKa=4.8
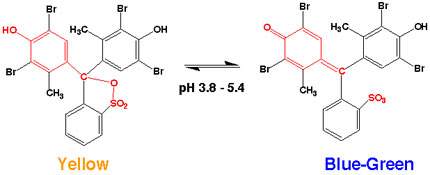
また、BCGの酸型,塩基型の分子構造は以下の通りです。
引用:キリヤ: Q&A
通常は上記に示した酸型で存在しますが、解離されると塩基型になります。この時の色変化を利用して、吸光度とpHの関係を求めることができます。詳しくは、次章の「実験操作」で解説しますので、そちらをご覧ください。
2、実験操作

まず、分光光度法の原理について説明いたします。
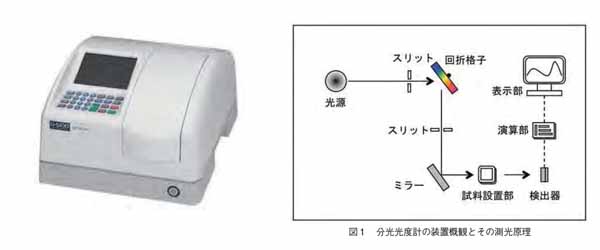
分光光度法とは、分光光度計を用いて特定の波長の光の強度、すなわち光の吸光度を測定する方法であります。
ここで用いる分光光度計の原理は、次の通りです。光源からの光を回折格子(またはプリズム)より特定波長に分光して、その単色光をセルに入射させ、その後の光の強度(吸光度)を検出器を用いて測定できるというものです。
分光光度計の原理の模式図は以下の通りです。
また、吸光度はランベルト―ベールの法則によって、他の値との相互関係性を求めることができます。
ランベルト-ベールの法則は以下のようであります。
A=log(I0/I)=a・l=ε・C・l
A:吸光度(abs),I0:入射光の強度,I:透過光の強度,a:吸光係数(abs/cm),ε:モル吸光係数(abs・L/cm・mol),吸収物質の濃度(mol/L),l:光路長(cm)
ただし、この法則が成立するのは、会合などの分子の状態変化が起こらない程度の希薄な溶液であることに注意する必要があります。なお、本実験で用いるBCG溶液は希薄な溶液であるため、ランベルト―ベールの法則は成り立つものとして話を進めます。
ここからは、具体的な酸解離定数測定の原理について説明していきます。大きく分けて測定方法は2つあります。
1つ目について説明いたします。
まず、pKについてです。pKとは、電離指数のことです。弱酸、弱塩基の電離定数をKa、Kbとするとき、-log Ka=pKa、-logKb=pKbと定義します。この時のpKaとpKbの総和がpKであります。
中和滴定の当量点のpHに近いpKを選ぶことで終点を見分けることができます。また、これには、温度が極めて重要で、温度が上がるにつれて、大きくなります。
酸塩基、今回の場合は特に弱酸(弱塩基)指示薬について、以下のような解離平衡が成り立ちます。ここでのHAは弱酸、A-は弱塩基を示します。
HA ⇄ H++ A-
また、本実験で用いる指示薬であるBCG溶液は希薄であるため、各化学種の活量係数は1に近似することができます。
活量係数が1であるとして、上記の反応式の平衡定数をKとすると以下の式が成り立ちます。
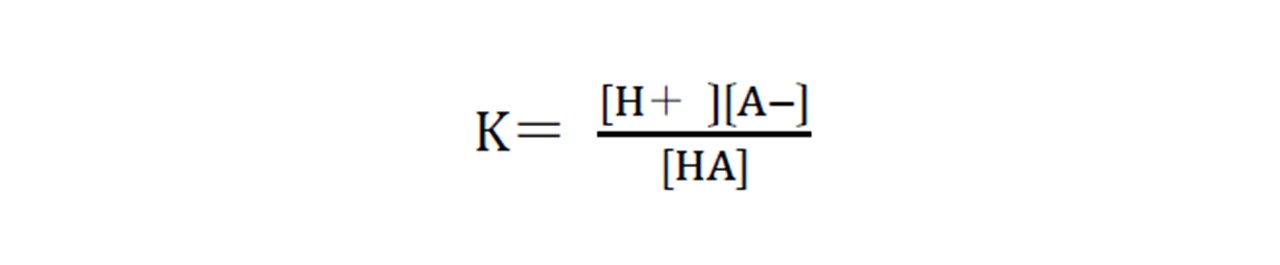
この式の両辺に常用対数(-log)をとると以下のようになります。
-logK=-log[H+]-log[A-]/[HA]
すなわち、以下のように表すことができます。
pK=pH-log[A-]/[HA]…①
本実験で用いるBCGの酸型,塩基型の状態での色は「1.BCC」の図から分かるように異なります。
すなわち、HA,A-での吸収スペクトルが異なることが分かります。このHA,A-の存在比によって吸光度の値が異なります。
すなわち、HAの濃度をC(mol/L),吸光度をA(abs),見かけのモル吸光係数をε(abs・L/cm・mol)、解離時のHAの濃度をCHA(mol/L),解離時のA-の濃度をCA-(mol/L),解離時のHAのモル吸光係数をεHA(abs・L/cm・mol),解離時のA-のモル吸光係数をεA―(abs・L/cm・mol)、光路長をl(cm)として、ランベルト―ベールの法則を用いると以下のような関係を示すことができます。
A=ε・C・l=(εHA CHA+εA―CA-)・l
酸性が強い溶液では、HAの濃度が圧倒的に高いため、モル吸光係数は、εHAであると近似することができます。
すなわち、酸性が強い溶液の吸光度から近似値ですが、εHAを算出できます。
同様に、塩基性が強い溶液では、A-の濃度が圧倒的に高いことから、εA―を算出できます。
さらに、C=CHA+CA-であることを用いると以下の関係が得られます。
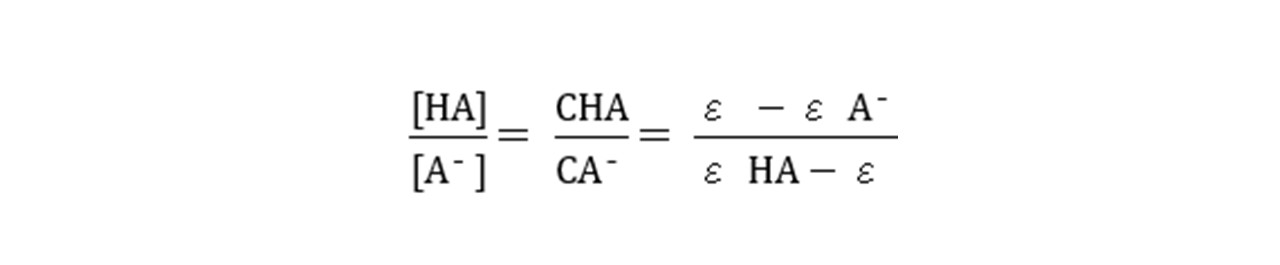
上記の式を①式に代入すると以下のようになります。
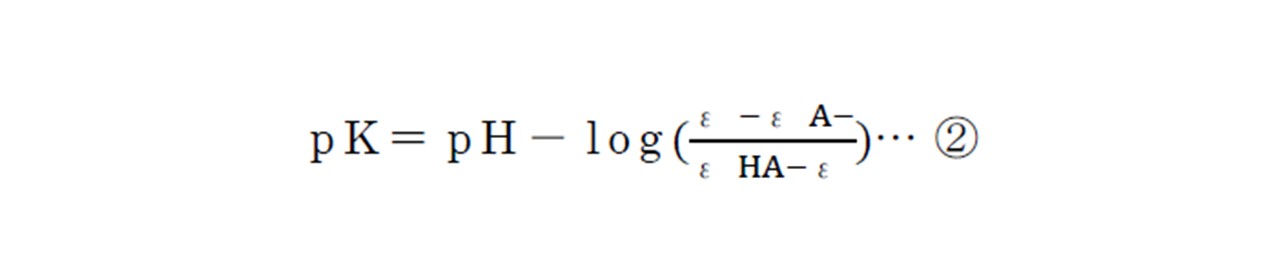
この式を用いると、酸性および塩基性が極めて高いところから算出したεHA,εA―,pHを測定した溶液のεが分かればpKの値が求まります。
2つ目について説明します。
縦軸にモル吸光係数,横軸にpHをとると以下のようなS字曲線状のグラフが得られる。
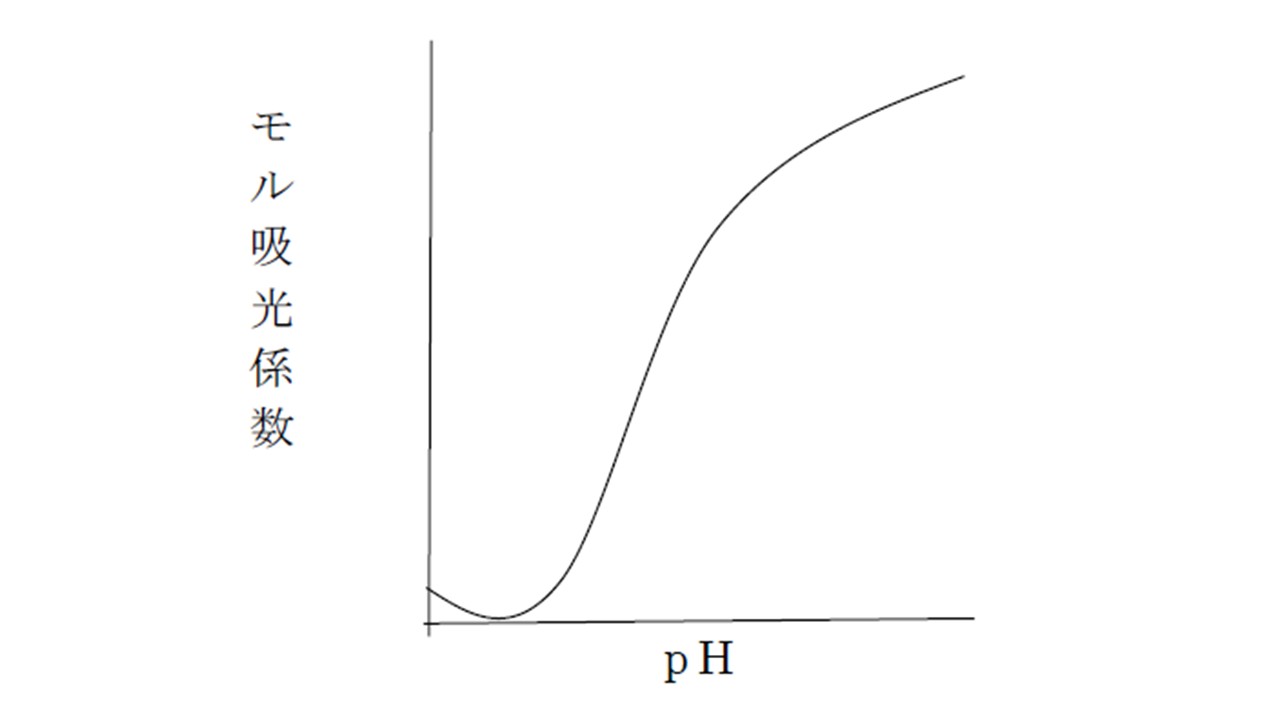
このグラフのモル吸光係数が最大のところをεMAX、最小のところをεminとすると、この2つの中点ε‘は以下のように求まります。
ε‘=(εMAX+εmin)/2
このときのε‘の値は、HAとA-の濃度が等しいときのモル吸光係数であります。
これは、1つ目のpK値の測定法のところで示したように、pHが高いところ(εMAX)は、A-のみ存在していると近似できますし、pHが低いところ(εmin)は、HAのみ存在していると近似することができるためです。ε‘のとき、CHA=CA-であるとすると、この値を式①に代入すると以下のようになります。
pK=pH-log[HA]/[HA]
pK=pH-log1
pK=pH
すなわち、S字曲線状のグラフの縦軸がε‘のときの、pHがpKであるといえます。
これによりpKを測定することができます。また、本実験では、この2つ目の方法を用いて実験を行っています。
3、緩衝溶液

今回は、実験で使用した緩衝溶液が弱酸とその塩の溶液であることから、酸の緩衝溶液について解説いたします。
緩衝溶液の緩衝能は、以下の式で説明できます。
pH=pK(一定)+log[A-]/[HA]
酸が加えられた場合には、ルシャトリエの原理に従ってA-がHAに変換されます。
このため、A-とHAの比は一定を保つため、濃度は変化しません。また、塩基が加えられた場合には、中和に用いられた量と同量のHAが解離してA-が生成するため、A-とHAの比は一定に保たれます。このため、濃度は変化しません。
これらの緩衝溶液の酸、塩基を受け入れる限界は以下の式で定義されます。
β=dCBOH/dpH=-dCHA/dpH
緩衝溶液の緩衝能は濃度によって支配されますが、濃度比によっても支配されます。
「2、実験操作」でも説明しましたが、HA=A-のとき緩衝能は最大になります。
これは弱酸の滴定の中点に相当します。すなわち、緩衝能はpH=pK±1の範囲で定義されます。
4、~まとめ~
いかがでしたか?
今回は、BGCのpHに対する吸光度変化を測定し、BGCの酸解離定数を求める実験について、BGC,実験操作,緩衝溶液という3つのキーワードから説明しました。どの章も重要なのでしっかりと抑えておきましょう。
また、参考文献は以下の通りになります。
1、柴田正三,吉川正道「分析化学」1974、p 23,1412
最後になりますが、参考文献以外はコピペ厳禁です。バレます。気を付けてください。自分で理解してまとめてください。
また、完全に情報を網羅しきれていないと思いますので、質問等ありましたら、下のコメント欄にコメントお願いします。
今回の記事は以上になります。最後まで読んでいただき、ありがとうございました。